中国医药研发外包服务市场概览
CRO提供涵盖药物发现、临床前和临床阶段的开发解决方案,提供DMPK、安全毒理学、生物分析、临床试验监测、SMO、数据管理和统计分析等服务。
中国医药研发投入规模及预测按药物发现、临床前及临床阶段划分
2020年,我国医药总研发投入达到1,703亿人民币,其中临床阶段研发投入最大,为1,130亿人民币,药物发现和临床前分别为305和386亿人民币。随着国家政策的支持和医药需求的不断扩大,以及向创新药转型的迫切需求,预计我国医药研发投入将持续增长,到2025年达到3,423亿人民币,年复合增长率为15.0%。
按药物发现、临床前及临床阶段划分的中国研发开支及明细(2016年至2025年(估计))
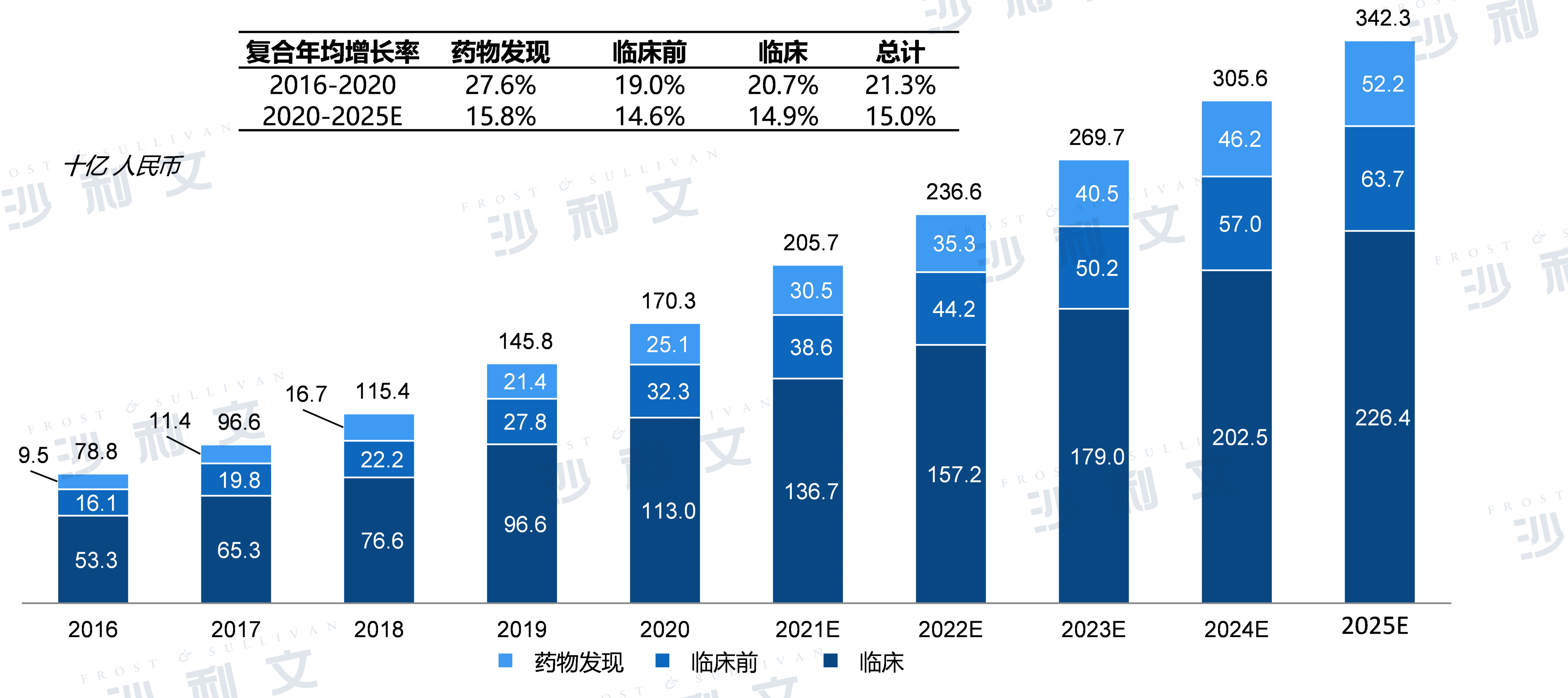
资料来源:弗若斯特沙利文分析
中国CRO服务市场规模
自2016年至2020年,中国CRO市场从220亿人民币长到522亿人民币,复合年增长率为24.1%。未来市场将保持快速增长,预计于2025年接近1583亿人民币,2020年后复合年增长率为24.9%。
中国CRO服务市场规模,2016-2025E
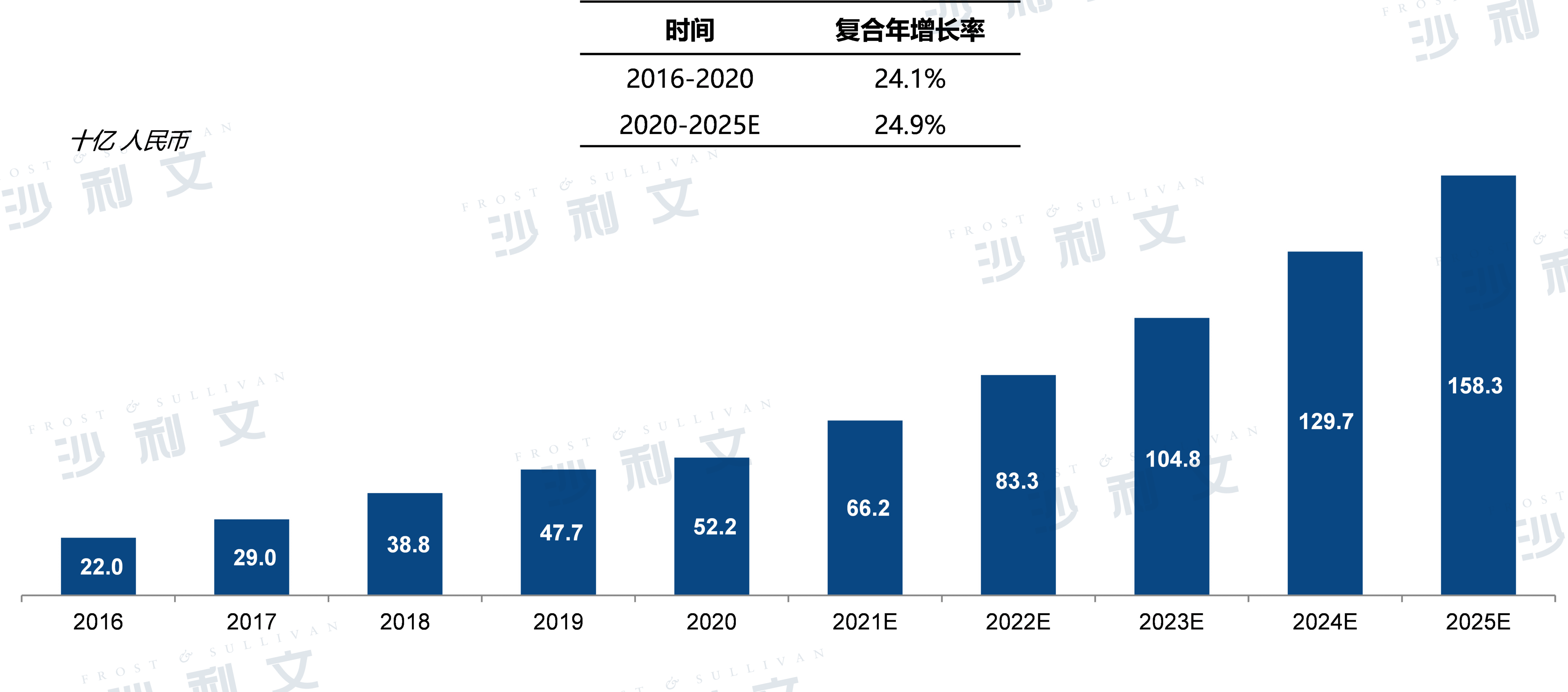
来源:弗若斯特沙利文分析
医药非临床CRO市场分析
医药非临床CRO业务模式、主要服务内容及其在医药产业链中的优势作用
医药非临床CRO业务主要包括药物发现和临床前研究。其中临床前外包服务包括以下专业服务:生物分析研究、安全性和毒理学研究、DMPK研究和体内外疗效研究。《药品注册管理办法》规定,临床前药品研究应当执行有关管理规定,其中安全性评价研究必须执行《实验室质量管理规范》。药品注册申请人可以将药品临床前研究的部分或者全部工作委托给研究室,但对证明药品安全、有效、质量可控的研究证据的真实性负责。
医药非临床CRO主要服务内容-临床前研究
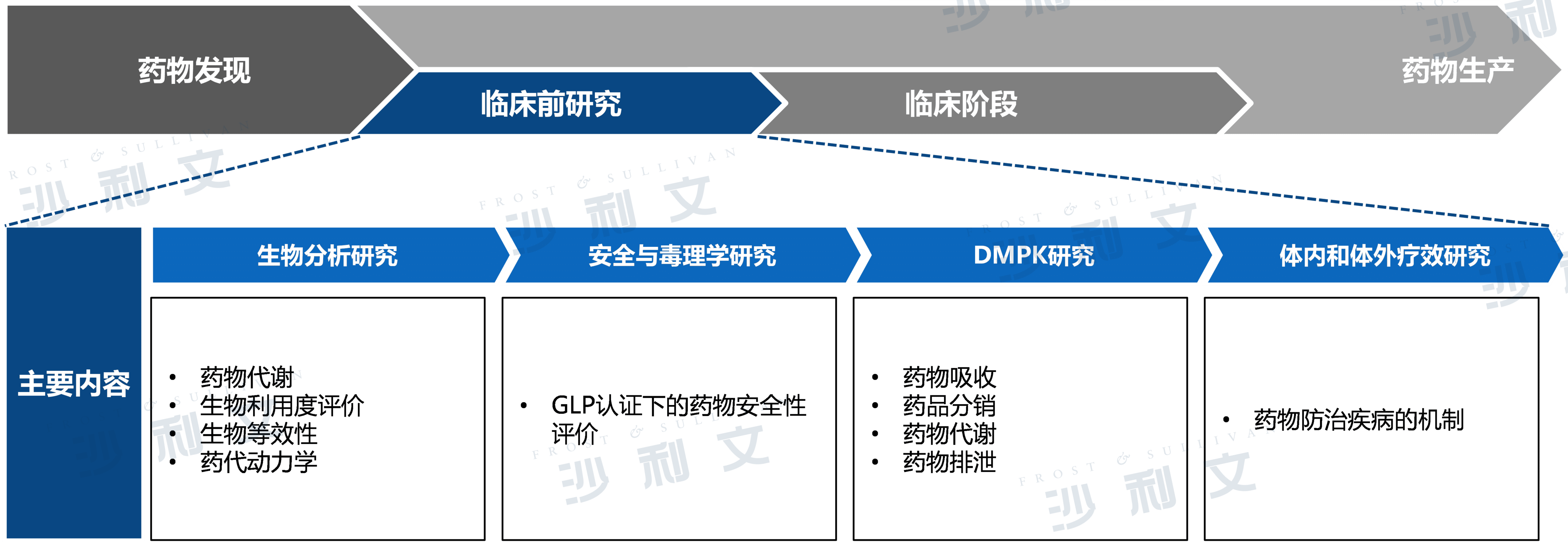
来源:弗若斯特沙利文分析
非临床药物安全性评价服务
非临床药物安全性评价简介
非临床安全性评价研究是指通过动物体内和体外系列研究全面评价候选药物的安全性,是新药申请IND并进入临床试验或申请NDA的必要程序和重要步骤。主要包括安全药理学试验、单次给药毒性试验、重复给药毒性试验、生殖毒性试验、遗传毒性试验、致癌试验、局部毒性试验、免疫原性试验、免疫毒性试验等药物安全性评价研究试验。
药物安全性问题是导致药物研发失败的重要因素,也是上市药物出现撤市问题的主要原因之一。候选药物在进入人体临床试验前,均需进行全面的安全性评价,从而降低药物因严重的毒性反应而导致研发失败的经济损失,因此意义重大。
非临床药物安全性评价简介
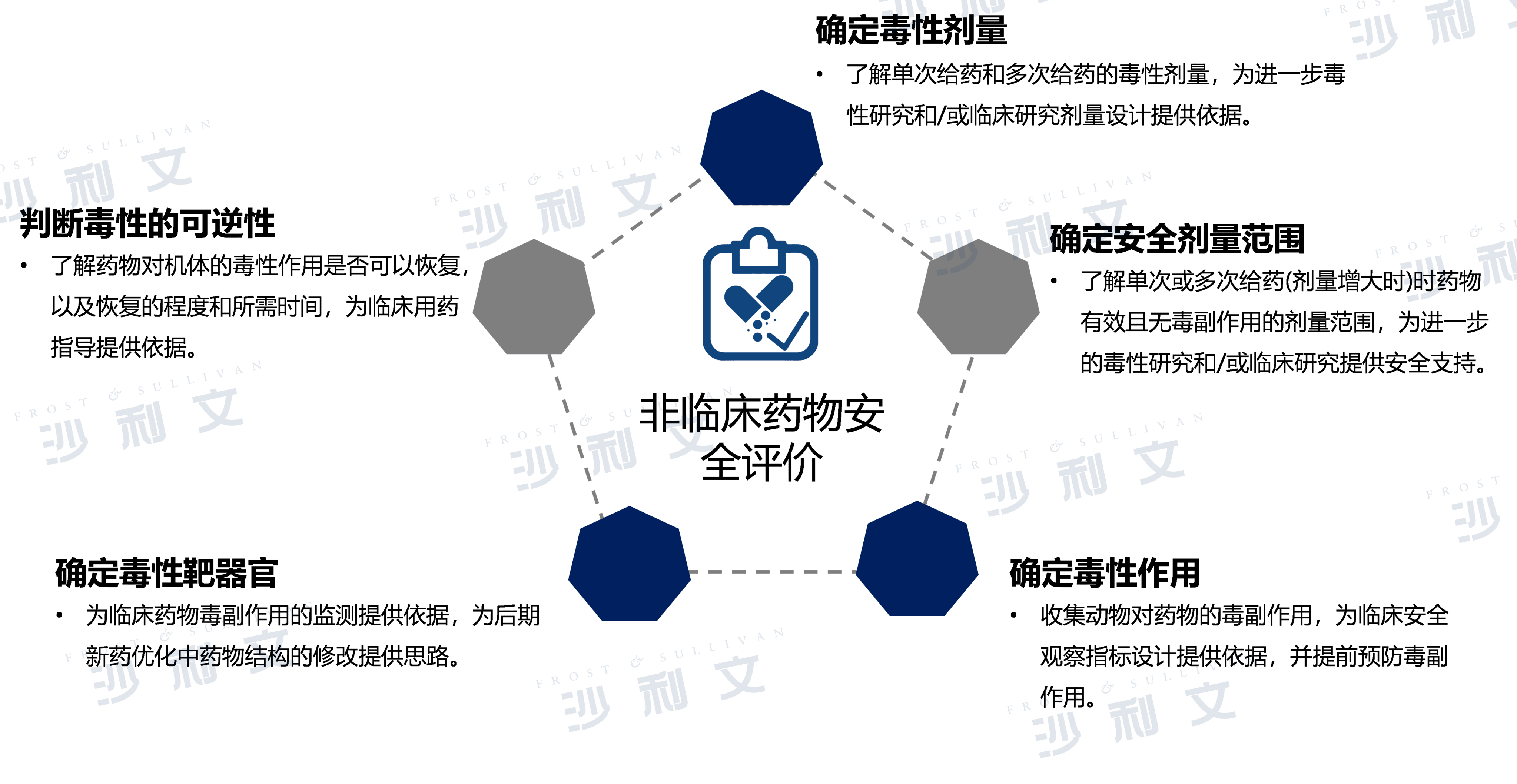
来源:弗若斯特沙利文分析
非临床药物安全性评价服务内容分类介绍
非临床药物安全性评价服务的主要内容包括如下类别:
非临床药物安全性评价服务内容分类介绍
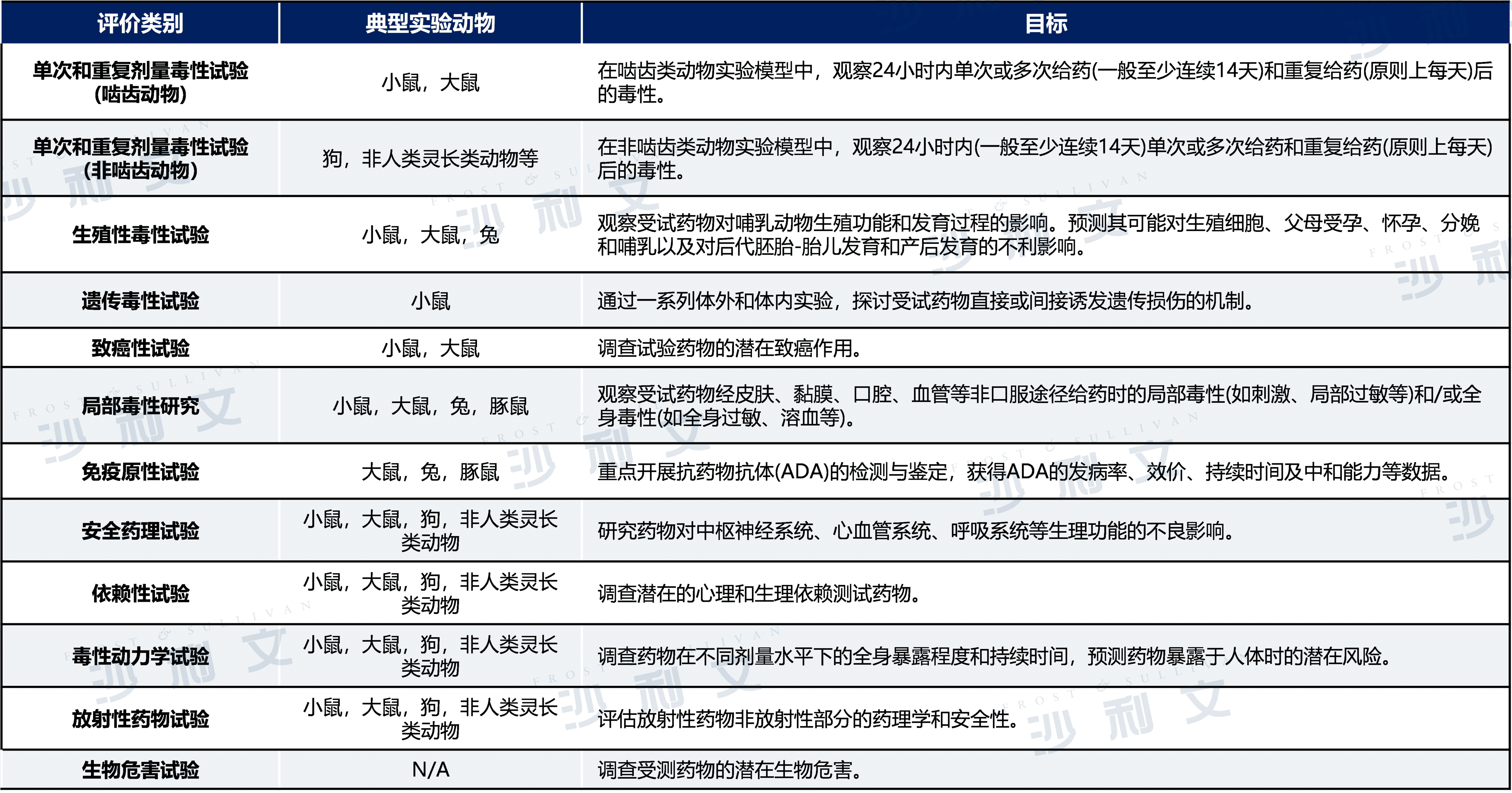
来源:弗若斯特沙利文分析
GLP制度概览
GLP指进行体内或体外实验及在实验室条件下的测试系统对试验品进行前瞻性研究以确定其安全性的最低基本规定。尽管GLP于各司法权区存在细微差异,但其通常对机构结构、人员、设施、设备维护及校准以及实验材料的使用和保存(试剂和实验模型)施加类似规定。
GLP制度概览
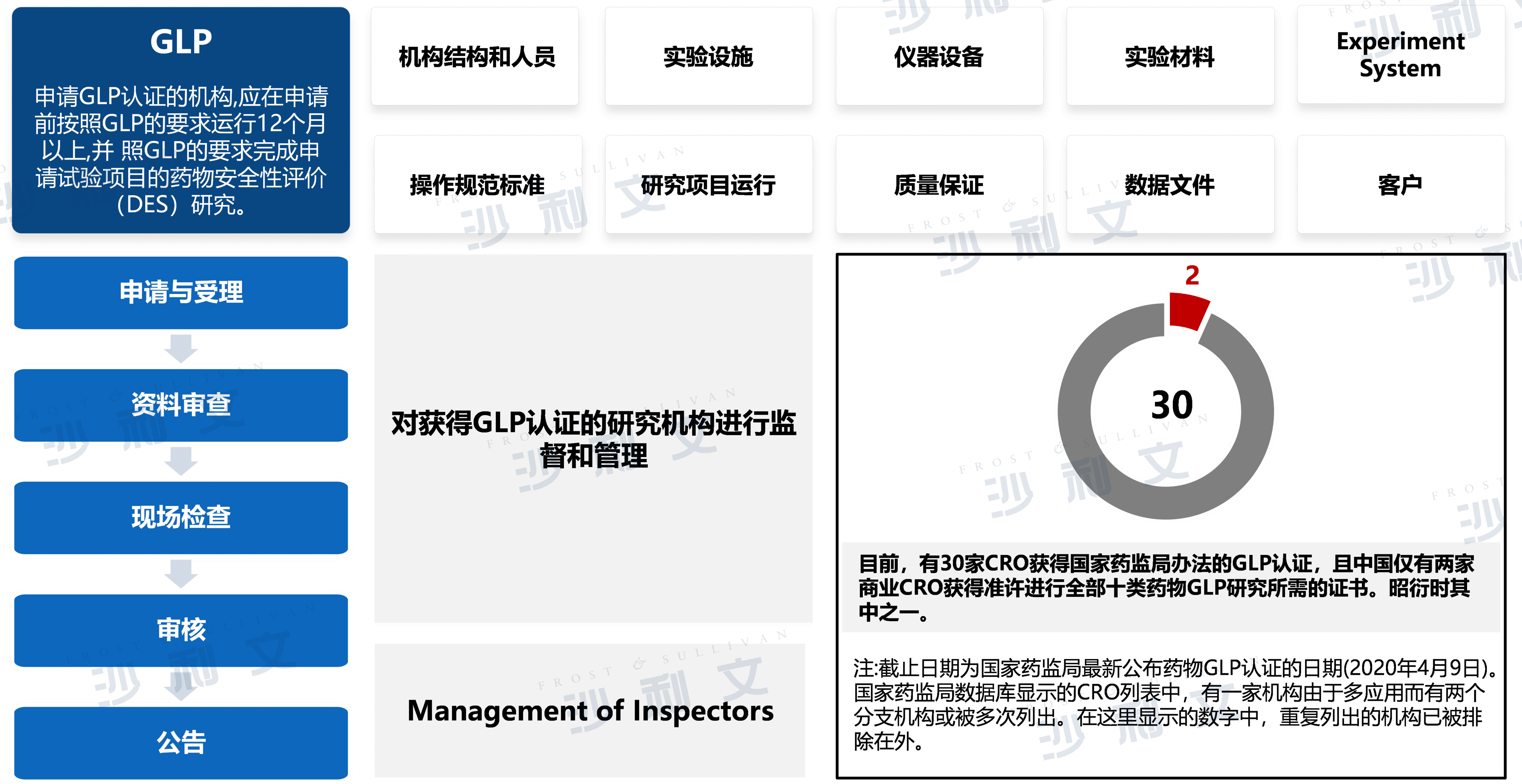
来源:弗若斯特沙利文分析
中国非临床药物安全性评价市场规模,2015-2024E
中国非临床药物安全性评价市场规模2015年约1.38亿美元,2019年增至4.16亿美元,复合年增长率为31.7%。未来五年,中国的非临床安评市场预计将保持快速增长,2024年将达到19.671亿美元,复合年增长率为36.5%。
中国非临床药物安全性评价市场规模,2015-2024E
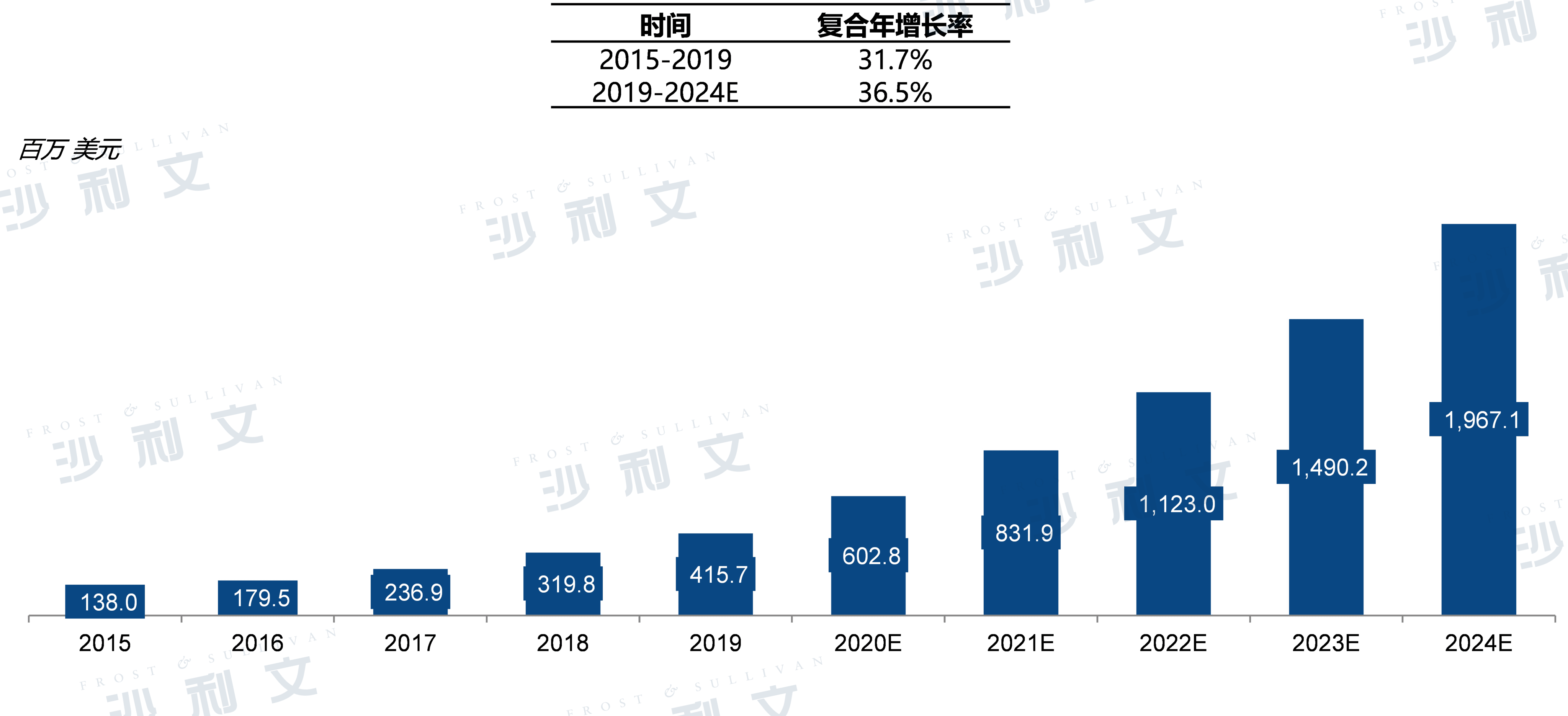
来源:弗若斯特沙利文分析
非临床药物安全性评价服务市场驱动力分析
不断增长的创新药市场。中国制药行业正处于从仿制药转向创新药的战略转型期,且创新药市场呈现出良好的增长态势。与仿制药和生物类似药不同,创新药需要进行非临床安全性评价。随着创新药制剂的发展,非常规给药途径的范围将扩大,例如通过眼睛、耳朵和鼻腔等特殊途径给药。因此,非临床药物安全性评价服务提供商须拥有更强的药物安全性评价实力。有关服务的发展将成为非临床药物安全性评价服务行业的主要驱动因素。
不断扩大的生物制剂市场。生物制剂对包括癌症和慢性疾病在内的各类病症具有出色的治疗效果。中国的生物制剂市场正在迅速扩大,其复合年增长率领先于整个制药市场。由于特殊的结构及特性,特别是细胞及基因疗法,生物制剂具有特殊性及复杂性。因此,用于化学药品的常规和常见的非临床药物安全性评价可能不完全适用于生物制剂。例如,用于基因和细胞疗法的非临床药物安全性评价包括对单次及重复给药毒性试验及免疫原性试验进行的评价以及其他评价类型。
规范审批流程。中国政府已经发布多项监管政策,以进一步规范新药临床试验申请审批流程。随着治疗性及预防性生物制剂非临床药物安全性评价详细指导原则的出台,中国非临床药物安全性评价日趋严格,符合人用药品注册技术要求国际协调会议的国际标准。因此,多年来,非临床药物安全性评价流程的整体效率一直在提高。
非临床安全性评价服务市场的发展趋势
协同效应。由于非临床药物安全性评价服务组织对候选药物进行临床前评价,其积累有关候选药物的机构经验和知识,并在设计和分析后续的临床试验时处于有利地位。通过提供临床研发服务,药物安全性评价服务组织为客户提供无缝一站式体验以减少各种交易成本,从而为其提供有说服力的价值主张。此外,药物安全性评价服务组织可能因协调研发流程及利用其对候选药物试验的机构知识和经验而实现更好的协同效应。
增值服务。专业团队对潜在药物的特性、安全性风险和危害有深刻的了解。因此,其可就开展药物安全性评价服务向客户提供见解,包括全面的药物评价和后续研发建议。该等补充见解可有效协助企业与客户建立良好的关系
数字化及数据分析。科学数据为非临床药物安全性评价业务的核心。IT安全和数据处理软件将不断改进,以实现全球化的数据库和数据分析。我们将为客户推出一个完全虚拟化的平台,以为其带来更好的用户体验,范围涵盖销售报价到试验设计及监控再到数据仓储、分析及可视化工具。
行业整合。在中国仅少数几家具有较强能力提供符合国际标准的综合服务的领先合同研究组织才能推动行业的发展。对于规模较小的市场参与者来说,通过为主要客户开展日益复杂的项目来获得市场份额变得越来越困难。因此,预期非临床药物安全性评价服务行业将在未来进行整合,且领先的参与者预期将收购该行业中规模较小的参与者。


